 Primeiro deves saber o que é um espetro atómico
Primeiro deves saber o que é um espetro atómico
Espetro de emissão e de absorção
Um espetro atómico, é característico de determinado elemento químico, e neste caso será estudado o átomo de hidrogénio, o átomo mais simples.
As figuras 1 e 2 representam os espetros de emissão e de absorção, no visível, do átomo de hidrogénio.
A Figura 1 resulta da emissão de radiação, no visível, por átomos em processos de desexcitação (cada risca é originada por transições de eletrões de níveis superiores para níveis inferiores).

A Figura 2 resulta da absorção de radiação, também apenas no visível, por átomos em processos de excitação (riscas pretas correspondentes à radiação absorvida pelos átomos para que eletrões transitem para níveis superiores.

Séries do espetro de hidrogénio
As séries do espetro do átomo de hidrogénio, algumas das quais apresentadas na Figura 3, representam conjuntos de transições entre diferentes níveis eletrónicos desse átomo. As séries são chamadas de Lymann, Balmer, Paschen e Pfund.
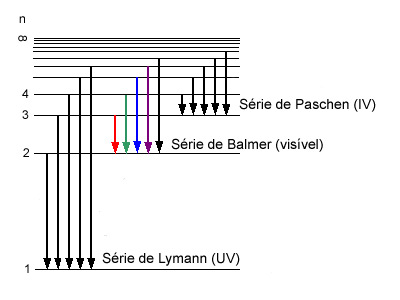
Série de Lymann
Conjunto de ricas correspondentes a transições do eletrão do átomo de hidrogénio entre os níveis 2, 3, 4... e o nível 1. Estas riscas correspondem a radiação na zona dos ultravioleta (UV).
Série de Balmer
Conjunto de ricas correspondentes a transições do eletrão do átomo de hidrogénio entre os níveis 3, 4, 5... e o nível 2. As quatro primeiras riscas, as menos energéticas, correspondem a radiação na zona do visível.
Série de Paschen
Conjunto de ricas correspondentes a transições do eletrão do átomo de hidrogénio entre os níveis 4, 5, 6... e o nível 3. As riscas correspondem a radiação na zona do infravermelho (IV).
Série de Pfund
Conjunto de ricas correspondentes a transições do eletrão do átomo de hidrogénio entre os níveis 5, 6, 7... e o nível 4.
