A matéria em que tocamos, ou vemos, desde as substâncias ao nosso redor às galáxias mais distantes, é constituída por átomos organizados de variadíssimas formas.
Os átomos, por sua vez, são constituídos por três tipos de partículas: protões, neutrões e eletrões (na realidade são constituídos por eletrões, quarks up e quarks down, já que os protões e neutrões são constituídos por combinações destes quarks).
No núcleo (o centro) do átomo estão os protões e os neutrões, enquanto os eletrões encontram-se em seu redor. Devido à sua localização, os protões e os neutrões são também conhecidos como nucleões.
Os eletrões de um átomo ocupam determinados níveis de energia (o número de eletrões em cada nível de energia é expressa pela distribuição eletrónica).
Ao contrário do Modelo atómico de Bohr, os eletrões não se encontram em órbitas bem definidas, correspondentes aos níveis de energia. No modelo atual, apenas conhecemos a probabilidade de encontrar cada eletrão de um átomo numa região do espaço, uma orbital.
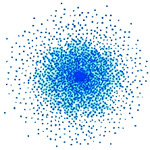
Na Figura 1 está representada a nuvem eletrónica de um átomo. Esta nuvem representa a probabilidade de encontrar os eletrões num determinado local do espaço, representando a soma das diferentes orbitais ocupadas por eletrões.
Na Tabela 1 estão identificadas algumas propriedades das partículas constituintes do átomo e ano e autor da sua descoberta.
Tabela 1 - Partículas constituintes do átomo.
|
Partícula |
Ano da |
Autor da |
Carga elétrica |
Massa |
|
1897 |
negativa (-) |
9,109 389 7 × 10-31 kg |
||
|
1914 |
positiva (+) |
1,672 623 1 × 10-27 kg |
||
|
1932 |
neutra |
1,674 928 6 × 10-27 kg |
Enquanto que o núcleo (protões e neutrões) é o responsável pela massa do átomo na sua quase totalidade, é a nuvem eletrónica (constituída pelos eletrões em movimento) a responsável pelo tamanho do átomo.
É o número de protões (número atómico) que diferencia um elemento químico (tipo de átomo) de outro. Um átomo que tenha 10 protões pertence a um elemento diferente de um átomo que tenha 11 protões.
Cada átomo tem um número igual de protões e de eletrões, o que o torna eletricamente neutro.
Quando um átomo ganha ou perde um ou mais eletrões, deixa de ter carga elétrica neutra e passa a ser um ião. No caso de ganhar um ou mais eletrões passa a ser anião (ião negativo). Se o átomo perder um ou mais eletrões passa a ser um catião (ião positivo).
