No século V a.C., o filósofo grego Demócrito imaginou a matéria constituída por pequenas partículas indivisíveis - átomos (derivada da palavra grega indivisível). Esta ideia não foi aceite e só muito mais tarde é que foi retomada por Dalton.
Modelo atómico de Dalton
Dalton, no séc. XIX, retomou a ideia dos átomos como constituintes básicos da matéria. Para ele os átomos seriam partículas pequenas, indivisíveis e indestrutíveis (Figura 1).

Cada elemento químico seria constituído por um tipo de átomos iguais entre si. Quando combinados, os átomos dos vários elementos formariam compostos novos.
Modelo atómico de Thomson (Modelo do Pudim de Passas)
Em 1897, Thomson descobriu partículas negativas muito mais pequenas que os átomos, os eletrões, provando assim que os átomos não eram indivisíveis.
Formulou esta teoria, de que os átomos seriam constituídos por uma parte central esférica com carga elétrica positiva onde estariam dispersos os eletrões, em número suficiente para que a carga total do átomo fosse nula (Figura 2).

Modelo atómico de Rutherford
Mais tarde, Rutherford demonstrou que a maior parte do átomo era espaço vazio, estando a carga positiva localizada no núcleo (ponto central do átomo), tendo este a maior parte da massa do átomo. Os eletrões estariam a girar em torno do núcleo (Figura 3).
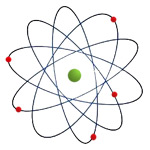
Rutherford também descobriu a existência dos protões, as partículas com carga positiva que se encontram no núcleo.
Este modelo não explica porque é que os eletrões não caem no núcleo, devido à atração que apresentam pelas cargas positivas aí existentes.
 Espalhamento de Rutherford [© PhET]
Espalhamento de Rutherford [© PhET] Experiência de Rutherford [© Raymond Chang]
Experiência de Rutherford [© Raymond Chang] 
Modelo atómico de Bohr
Em 1911, Bohr apresentou alterações ao modelo de Rutherford: os eletrões giram em torno do núcleo mas só podem ocupar níveis de energia bem definidos, em que cada nível de energia corresponde a uma órbita em torno do núcleo (Figura 4).
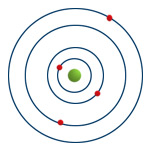
As órbitas mais interiores representam níveis de energia mais baixa e à medida que se encontram mais afastadas do núcleo o valor da energia desse nível é maior.
Os eletrões tendem a ocupar os níveis de menor energia (mais interiores, mais perto do núcleo) para que o átomo tenha a menor energia possível - estado fundamental do átomo. Quando um eletrão recebe uma determinada quantidade de energia passa a ocupar uma órbita mais externa ficando o átomo num estado excitado. Se um eletrão passar de uma órbita para uma outra mais interior liberta energia.
Embora este modelo seja muito usado para explicações simples do funcionamento do átomo (os níveis representados por órbitas são fáceis de desenhar e/ou representar) este não é o modelo atual do átomo.
 A Evolução do Modelo Atômico [© Univesp]
A Evolução do Modelo Atômico [© Univesp]
