A distribuição eletrónica de um átomo demonstra como estão distribuídos os eletrões pelos vários níveis e subníveis de energia do átomo.
Esta distribuição segue as seguintes regras:
Princípio da energia mínima
Um nível (ou subnível) de energia só começa a ser preenchido quando o anterior (de menor energia) já está completo. Uma configuração eletrónica que obedeça ao Princípio da energia mínima corresponde a um átomo no estado fundamental, mas um átomo excitado também tem uma distribuição eletrónica.
Princípio de exclusão de Pauli
Wolfgang Pauli enunciou este princípio em 1925.
Princípio de exclusão de Pauli
No mesmo átomo não pode haver dois eletrões que tenham o mesmo conjunto de todos os números quânticos.
Como apenas o número quântico de spin é relativo ao próprio eletrão, e este número quântico apenas tem duas possibilidade (+½ e -½, ou α e β), uma consequência deste princípio é de que não podem estar mais do que dois eletrões em cada orbital. A outra consequência é que no caso de dois eletrões ocuparem a mesma orbital estes terão que ter valores de spin diferentes, tendo um o valor \(m_{s}\) = +½ e o outro, obrigatoriamente, \(m_{s}\) = -½.
Regra de Hund
Na ocupação dos eletrões por orbitais do mesmo subnível (por exemplo, as orbitais p de um mesmo nível \(n\)) todas as orbitais terão de estar semi preenchidas antes de começarem a ser preenchidas com dois eletrões cada. Isto permite que as repulsões entre os diversos eletrões no mesmo subnível sejam menores.
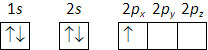
No caso do boro (\(Z\) = 5) a distribuição eletrónica é 1s2 2s2 2px1, e pode ser representada pelo seguinte diagrama (cada seta representa um eletrão, e os diferentes sentidos das setas os valores de spin +½ e -½, sendo o uso das duas setas – para cima e para baixo – indiferente):
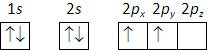
No átomo de carbono (\(Z\) = 6) já existem dois eletrões a distribuir pelo subnível 2p, que, pela regra de Hund são distribuídos por duas das três orbitais 2p (2px, 2py e 2pz):
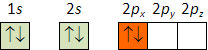
A seguinte distribuição é incorreta:
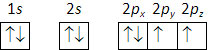
Desta forma, a distribuição eletrónica do oxigénio (\(Z\) = 8) é:
O néon (\(Z\) = 10) terá a distribuição:
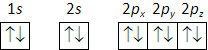
Diagrama de Pauling
O Diagrama de Pauling é um método fácil para estabelecer a sequência de preenchimento dos eletrões pelas diferentes orbitais em função das energias.
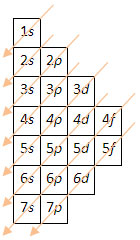
A ordem crescente de energia dos subníveis é:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p
Bibliografia
D. Reger, S. Goode, E. Mercer, "Química: Princípios e Aplicações", Fundação Calouste Gulbenkian, 2010.
D. B. Laserna, "Os Paradoxos Quânticos", edição especial da National Geographic, RBA Revistas Portugal, Lda, 2016.

 Hund
Hund