No modelo atómico de Rutherford já estava claro a existência de um núcleo atómico, muito pequeno relativamente ao tamanho desse átomo, e de eletrões em redor desse núcleo. O núcleo teria carga elétrica positiva, diferente de elemento químico para elemento químico, e os eletrões carga elétrica negativa. O número de eletrões seria em número suficiente para compensar a carga elétrica positiva do núcleo, sendo o átomo neutro.
Alguns fenómenos não eram explicáveis por este modelo até surgir o modelo atómico de Bohr, onde é introduzida a ideia de que os eletrões de um átomo não tem todos a mesma energia, mas não podem ter qualquer valor de energia. A energia dos eletrões num átomo é quantizada.
Isto quer dizer que para um átomo de um determinado elemento químico há níveis bem definidos de energia que os eletrões desse átomo podem ter. Quando os eletrões desse átomo ocupam níveis de energia o mais baixas possíveis, esse átomo encontra-se no estado fundamental.
O número de eletrões que podem ocupar os diferentes níveis de energia de um átomo é conhecido, originado a distribuição eletrónica desse átomo.
Excitação
Um átomo no estado fundamental pode receber determinadas quantidades de energia (uma quantidade muito bem definida e diferente de tipo de átomo para tipo de átomo) provocando a passagem de um eletrão para um nível de maior energia que esteja disponível (Figura 1) passando esse átomo a ter mais energia do que no seu estado fundamental - fica num estado excitado.
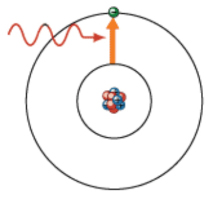
Para que este processo ocorra é necessário absorção de energia pelo átomo (luz é uma das formas de transferir energia para um átomo).
Desexcitação
O processo contrário ocorre quando um eletrão de um átomo num estado excitado "passa" para um nível de energia inferior desocupado (Figura 2).
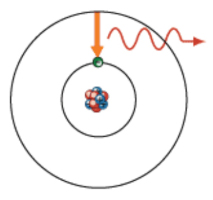
Neste processo há libertação de energia do átomo. Um espetro atómico é a consequência de desexcitações em que a libertação de energia ocorre sob a forma de luz.
Um átomo excitado irá, após uma ou mais desexcitações dos seus eletrões, atingir a sua energia mínima, voltando ao seu estado fundamental.
