Este tipo de ligações acontecem entre moléculas e são devidas a interações eletrostáticas (forças de atração e de repulsão devidas às cargas elétricas) e explicam porque é que estruturas moleculares se mantém, ou não, junto de outras. A partilha de eletrões nestas ligações é insignificante.
Este tipo de forças são mais fracas que as entre átomos (metálica, covalente e iónica).
Há dois tipos de ligações intermoleculares:
Forças de van der Waals
Forças dipolo-dipolo (Forças de Keesom)
Forças que acontecem entre moléculas polares.
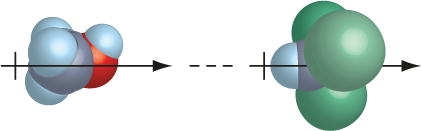
Forças dipolo-dipolo induzido (Forças de Debye)
Forças que acontecem entre uma molécula polar e uma molécula apolar.
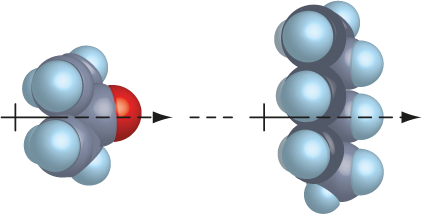
Forças dipolo instantâneo-dipolo induzido (Forças de London)
Forças que ocorrem entre moléculas apolares.
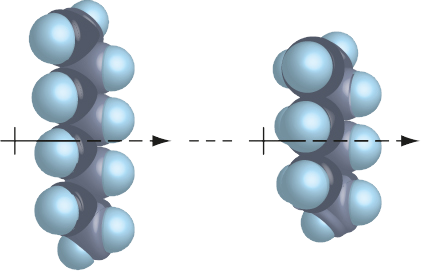
O aumento do número de eletrões das moléculas envolvidas aumenta, normalmente, a sua polarizabilidade (facilidade com que a molécula é polarizada), pelo que aumentará também a intensidade deste tipo de ligação. O aumento do número de pontos de contacto entre as diferentes estruturas provoca, também, o aumento da intensidade deste tipo de ligação.
Apesar de este tipo de ligação ocorrer entre todo o tipo de estruturas, polares e apolares, o seu efeito é mais relevante entre estruturas apolares (onde as restantes forças de ligação não existem).
Ligação de hidrogénio
Acontecem em moléculas que tenham na sua constituição grupos:
\(\text{-O-H}\)
\(\text{-N-H}\)
\(\text{-F-H}\)
Como a diferença de eletronegatividade entre o átomo de hidrogénio e os átomos de oxigénio, nitrogénio ou flúor, é bastante grande, na zona da nuvem eletrónica do hidrogénio é criado um dipolo bastante positivo. Isto possibilita a atração eletrostática com zonas de dipolos negativos de outras moléculas (Figura 4).
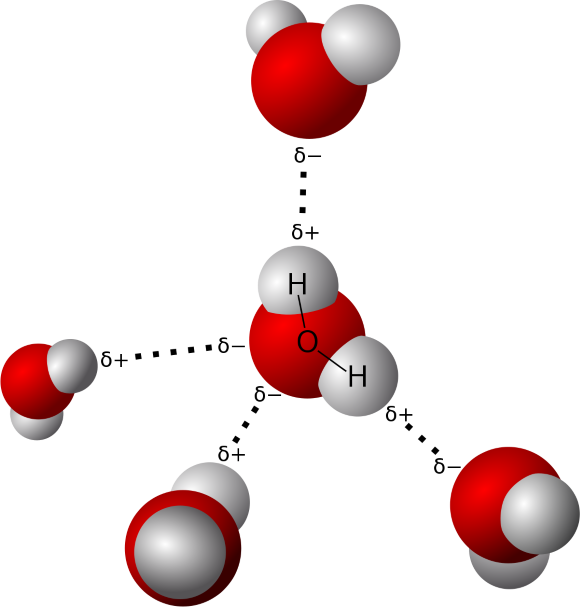
Este tipo de ligação é o mais forte das ligações intermoleculares.
 Porque é que o azeite e o vinagre não se misturam? [© Um Minuto de Ciência por dia não sabes o bem que te fazia]
Porque é que o azeite e o vinagre não se misturam? [© Um Minuto de Ciência por dia não sabes o bem que te fazia] Como é que as osgas não caem da parede? [© Um Minuto de Ciência por dia não sabes o bem que te fazia]
Como é que as osgas não caem da parede? [© Um Minuto de Ciência por dia não sabes o bem que te fazia]
